
martes, 30 de agosto de 2011
sábado, 27 de agosto de 2011
ELECTRODO DE CALOMEL
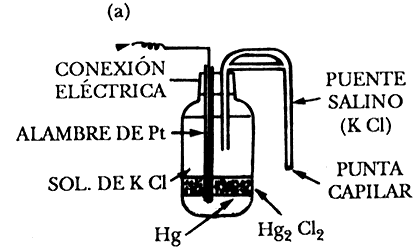
Electrodo de calomelanos. Este electrodo está formado por mercurio cubierto por una capa de cloruro insoluble (calomelanos), Hg2Cl2 en equilibrio con una disolución de cloruro potásico, KCl, que puede ser 0.1 N, 1 N o saturada. El contacto eléctrico con el mercurio se realiza por medio de un hilo de platino. Un esquema de este electrodo se presenta en la figura 7(a).
Así pues, si el electrodo actúa como ánodo (-) la reacción es hacia la izquierda, (oxidación); si el electrodo actúa como cátodo (+), la reacción es hacia la derecha,
(oxidación); si el electrodo actúa como cátodo (+), la reacción es hacia la derecha,  (reducción).
(reducción).
Hg2Cl2 + 2e-  2 Hg +2 Cl-.
2 Hg +2 Cl-.

Así pues, si el electrodo actúa como ánodo (-) la reacción es hacia la izquierda,
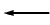 (oxidación); si el electrodo actúa como cátodo (+), la reacción es hacia la derecha,
(oxidación); si el electrodo actúa como cátodo (+), la reacción es hacia la derecha, 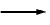 (reducción).
(reducción). 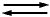 2 Hg +2 Cl-.
2 Hg +2 Cl-. ELECTRODOS DE REFERNCIA
L
OS PROCESOS que tienen lugar en la interfase metal-solución de cualquier metal en contacto con un electrolito (medio agresivo), no se pueden medir de una manera absoluta (tiene que ser tan sólo relativa). El metal en contacto con el electrolito tiene, por un lado, tendencia a disolverse, con lo que queda cargado negativamente. Me 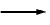 Men + + ne-
Men + + ne-
 Men + + ne-
Men + + ne- Me n + + ne- Me
Me  Me n+ + ne-
Me n+ + ne-
 Me n+ + ne-
Me n+ + ne-Se ha creado, pues, una diferencia de potencial entre el metal y el electrolito. Para poder medir esta diferencia de potencial se adoptó un electrodo patrón que es el electrodo normal de hidrógeno, al cual, por convención y a cualquier temperatura, se le asignó el valor cero.
Este electrodo está constituido por una lámina de platino-platinado, sobre la cual se hace burbujear hidrógeno gas a la presión de una atmósfera, sumergida en una solución ácida (electrolito), cuya actividad de iones hidrógeno a 25°C es la unidad, de acuerdo con la reacción de equilibrio:
2H++2e  H2
H2
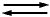 H2
H2 En las condiciones mencionadas, el potencial de este electrodo es únicamente función del pH, según la siguiente expresión:
E = 0.059 pH
Tomando como referencia el electrodo de hidrógeno, el potencial de un metal cualquiera sumergido en una solución de sus iones de actividad igual a la unidad, corresponde a la fuerza electromotriz de una pila, en la cual el semielemento metal/solución de sus iones actúa como polo positivo, o sea de cátodo, y el electrodo de H2 como polo negativo, o ánodo, según la convención propuesta por la Unión Internacional de Química Pura y Aplicada
(IUPAC), universalmente aceptada. Lo anterior lo podemos representar de una manera esquemática como: -Pt, H2 (1 atm)/H+(aH+ = 1)// Me n+/Me +,
donde una barra indica la presencia de una interfase y la doble barra significa la presencia de una unión electrolítica o puente salino entre ambos semielementos de la pila. En la convención propuesta, el polo negativo o ánodo se coloca en el lado izquierdo de la pila, en la forma en que tiene lugar la reacción de oxidación:
H2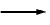 2H+ + 2e-.
2H+ + 2e-.
H2 + Me n +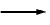 2H+ + Me.
2H+ + Me.
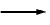 2H+ + 2e-.
2H+ + 2e-. Los electrones generados en esta reacción pasarán al otro electrodo, positivo o cátodo, a través de un conductor metálico externo, de cobre por ejemplo, donde los iones Me n + serán reducidos. La reacción global del proceso será la siguiente:
H2 + Me n +
 2H+ + Me.
2H+ + Me. E
pila = Ecátodo -Eánodo
b) E
pila < 0 El primer caso supone, dado que el electrodo de H2, por convenio, se toma con un potencial de 0 voltios, que necesariamente el semielemento que actúa como polo positivo debe de tener un potencial de reducción positivo, lo cual en términos energéticos equivale a decir que la reacción
Me n + + ne  Me
Me
 Me
Me está desplazada hacia la derecha. Un voltímetro que uniera los dos semielementos que constituyen la pila debería conectarse de tal manera que el polo (-) se uniera al electrodo de hidrógeno y el polo (+) al del metal. Es decir, el polo (+), de mayor potencial siempre (cátodo), se une a ese mismo polo del voltímetro y el polo (-), de menor potencial (ánodo), se une al negativo del voltímetro. En estas condiciones, la diferencia de potencial medida, correspondiente a la pila formada, sería numéricamente igual al potencial de reducción del semielemento derecho de la pila, Me n+/Me. Si se construyen pilas de estas características, se podrían determinar los potenciales de reducción de todos aquellos semielementos cuyo potencial es positivo o mayor que 0 (el del hidrógeno).
En el segundo caso, al ser el potencial de la pila menor que cero (negativo), esto implica necesariamente que el flujo de electrones irá en sentido contrario, es decir, que la producción de electrones se deberá a la oxidación (disolución) del metal del semielemento de la derecha:
Me Men+ + ne-,
lo cual implica que la reacción está desplazada hacia la derecha, favorecida energéticamente. Es tos electrones suministrados serán tomados por el otro semielemento, y tendrá lugar la siguiente reacción.
lunes, 22 de agosto de 2011
Toxicidad de reactivos (practica 2)
Cu(NO3)2
Toxicidad aguda
Tras inhalación de polvo: irritación leve de vías respiratorias
Tras contacto con la piel: irritaciones
Tras contacto con los ojos: fuertes irritaciones. Riesgo de turbidez en la córnea
Tras ingestión: vómito
Para nitritos/nitratos en general: methemoglobinemia tras absorción de grandes cantidades.
Protección personal
Uso de lentes, guantes y bata
Zn(NO3)2
Riesgos para la salud
Ingestión accidental: Puede causar irritación gastrointestinal, náuseas y vomito. De a beber inmediatamente leche o agua.
Contacto con los ojos: Causa irritación y lagrimeo de los ojos .Lavar suavemente con agua corriente durante 15 minutos abriendo ocasionalmente los párpados.
Contacto con la piel: Causa irritación de la piel. Lavar con agua corriente durante 15 min., quitarse la ropa contaminada y calzado.
Inhalación: Irritación en las vías tractorespiratorias puede causar metemoglinemia, cinusitis convulsiones, taquicardia, diarrea y en algunos casos la muerte. Traslade a un lugar con ventilación adecuada. Si respira con dificultad suministrar oxígeno.
FeSO4
Toxicidad aguda
Tras inhalación de polvo: tos, irritación en las vías respiratorias.
Tras contacto con la piel: irritaciones leves.
Tras contacto con los ojos: irritaciones leves.
Tras ingestión de grandes cantidades: vómito con sangre, descomposición, descenso de la tensión sanguínea
Para compuestos solubles de hierro: tras ingestión naúseas y vómito. Tras absorción de grandes cantidades: afecciones cardiovasculares. Efecto tóxico sobre el hígado y los riñones.
Protección personal
Uso de lentes, guantes y bata
KNO3
Efectos De Salud Agudos
La irritación a la piel y a los ojos cuando hay contacto. La inhalación causará la irritación a los pulmones y a la membrana mucosa. La irritación a los ojos causará lagrimeo y el enrojecimiento. El enrojecimiento, el descamarse y la comezón son características de la inflamación de la piel. Siga las prácticas seguras de la higiene industrial y use siempre el equipo protector al manejar este compuesto.
Protección personal
Uso de lentes, guantes y bata
**Pueden consultar estas y mas hojas de seguridad en la pagina http://www.quimica.unam.mx/cont_espe2.php?id_rubrique=54&id_article=1341&color=E6AD04&rub2=564 o en www.chemdat.info
sábado, 20 de agosto de 2011
celdas electroquimicas: historia y un poco más...
Las celdas electroquímicas fueron desarrolladas a finales del siglo XVIII por los científicos Luigi Galvani y Allesandro Volta por lo que también se las denomina celda galvánica o voltaica en su honor.
Una celda electroquímica es un dispositivo experimental por el cual se puede generar electricidad mediante una reacción química. Estos procesos electroquímicos son conocidos como “reacciones electroquímicas” o “reacción redox” .
La celda electroquímica consta de dos electrodos, sumergidos en disoluciones apropiadas, unidos por un puente salino y conectados por un voltímetro que permite el paso de los electrones.
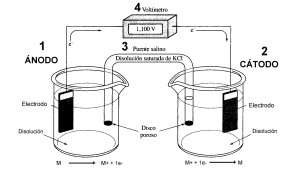
Sus componentes característicos son:
M ———> M+ + 1e-
Por convenio se define como el polo negativo.
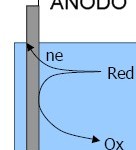
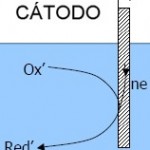
2. Cátodo: Es el electrodo sobre el que se produce la reducción. El agente oxidante gana electrones y por tanto se reduce.
M+ + 1e- ———> M
Por convenio se define como el polo positivo.
3. Puente Salino: Es un Tubo de vidrio relleno de un electrolito que impide la migración rápida de las sustancias de una celda a otra, permitiendo no obstante el contacto eléctrico entre ambas. El electrolito suele ser una disolución saturada de KCl retenida mediante un gel.
4. Voltímetro: Permite el paso de los electrones cerrando el circuito. Mide la diferencia de potencial eléctrico entre el ánodo y el cátodo siendo la lectura el valor del voltaje de la celda.
**Pueden consultar un poco más en
http://quimica.laguia2000.com/general/celdas-electroquimicas
Reacciones de óxido-reducción
Las reacciones de óxido – reducción o REDOX son aquellas donde está involucrado un cambio en el número de electrones asociado a un átomo determinado, cuando este átomo o el compuesto del cual forma parte se transforma desde un estado inicial a otro final.
La gran mayoría de las reacciones redox ocurren con liberación de energía. Por ejemplo: la combustión de compuestos orgánicos que proporciona energía calórica, las reacciones que se realizan en una pila o batería, donde la energía química es transformada en energía eléctrica, y las reacciones más importantes, desde el punto de vista de nuestro curso, que ocurren a nivel del metabolismo de un ser viviente.
**Si quieren repasar el metodo de balanceo de las reacciones redox, pueden consultar el libro "Química" de Andoni Garritz o "La química y tu" de J.A. Chamizo
Bienvenidos!
Hola compañeros! Somos el equipo 1, sean bienvenidos y esperamos que este blog sea de apoyo para ustedes.
Suscribirse a:
Entradas (Atom)